上一篇: 第一篇
下一篇: 左卡尼汀在男性不育中临床应用专家共识
中华医学会男科疾病诊治指南系列男性不育症诊疗指南
 2020.09.02
2020.09.02  6993
6993 编写组成员
黄翼然 上海交通大学医学院附属仁济医院(组长) 夏术阶 上海交通大学附属第一人民医院
陈斌 上海交通大学医学院附属仁济医院
匡延平 上海交通大学医学院附属第九人民医院戚广崇 上海中医药大学附属岳阳医院
王翔 复旦大学附属华山医院
平萍 上海交通大学医学院附属仁济医院滕晓明 同济大学附属上海第一妇婴保健院李铮 上海交通大学医学院附属仁济医院
编辑秘书
陈向锋 上海交通大学医学院附属仁济医院王鸿祥 上海交通大学医学院附属仁济医院胡凯 上海交通大学医学院附属仁济医院
一、男性不育症定义、流行病学及预后因素
二、男性不育症病因
三、男性不育症诊断四、男性不育症治疗
五、无精子症诊断与治疗
附录 1 男性不育症诊疗策略流程图 1
附录 2 男性不育症诊疗策略流程图 2
附录 3 无精子症诊疗策略流程图 3
一、男性不育症定义、流行病学及预后因素
(一)男性不育症定义
世界卫生组织(WHO)规定,夫妇未采用任何避孕措施同居生活 1 年以上, 由于男方因素造成女方不孕者,称为男性不育症。男性不育症不是一种独立疾病, 而是由某一种或很多疾病和(或)因素造成的结果[1]。
(二)男性不育症流行病学
据 WHO 调查,15%育龄夫妇存在不育问题,而发展中国家某些地区可高达30%,男女双方原因各占 50%[2, 3]。有研究认为,在过去的 20 多年里,高加索白种人男性的精子浓度以平均每年 2.6%速度下降,正常精子比例和活动力平均每年分别下降了 0.7%和 0.3%[4]。有报道显示我国男性的精液整体质量正以每年 1% 的速度下降[5]。但男性精液质量逐年下降的说法尚有争议,有研究显示精子浓度有下降趋势,但精子活力变化不大[6]。
(三)男性不育症影响因素
1. 不育持续时间 正常情况下,生育力正常的夫妇单月怀孕率 20%~25%, 半年怀孕率 75%,1 年怀孕率 90%。不育年限超过 4 年,则每月怀孕率仅约 1.5%[7]。
2. 原发性还是继发性不育 原发性男性不育症多为生精功能减退或障碍,也可以是先天性发育异常所致。继发性男性不育症多由后天因素所致,包括医源性损伤、生殖系统感染等。通常情况下,可通过治疗恢复生育力或通过辅助生殖技术获得自身后代。
3. 精液分析 是评估男性生育力的重要依据,结果异常提示生育力减退。精液参数中与生育力关系最密切的是精子总数与活力,而精子形态学检测对预测体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)的成功率有重要参考价值。
4. 女方年龄和生育能力 女方在 35 岁的生育力为 25 岁的 50%,至 38 岁下降到 25%,超过 40 岁可进一步下降到 5%以下。尽管各项辅助生殖技术不断进步和优化,女性年龄依然是影响怀孕成功率最为主要的因素之一。
二、 男性不育症病因
男性不育症是由多种疾病和(或)因素造成的结果,通常根据影响生殖环节的不同,分为睾丸前、睾丸和睾丸后三个因素,但仍有高达 60%~75%的患者找不到病因(临床称为特发性男性不育)。
(一)睾丸前因素
通常为内分泌性病因,患者的生育力损害继发于体内激素失衡。
1. 丘脑疾病
(1) 促性腺激素缺乏:卡尔曼综合征(Kallmann’s syndrome)是低促性腺激素型性腺功能低下的一种综合征。病变部位在下丘脑,伴嗅觉障碍或减退。由于下丘脑促性腺激素释放激素(GnRH)分泌障碍,导致促性腺激素分泌减少而继发性腺功能减退。
(2) 选择性黄体生成素(luteinizing hormone,LH)缺乏症:又称生殖性无睾症,罕见。临床表现为不同程度的雄性化和男乳女性化的类无睾体征。患者睾丸容积正常或略大,精液量少,偶见精子。镜下可见成熟生精上皮,但间质细胞(Leydig cell)少见,血清激素检查 LH 缺乏[8]。
(3) 选择性卵泡刺激素(follicle stimulating hormone,FSH)缺乏症:极为罕见,垂体 FSH 分泌不足,而 LH 正常,患者临床表现为有正常男性第二性征和睾丸容积,无精子症或极度少精子症[9]。
(4) 先天性低促性腺激素综合征:继发于数种综合征的性腺功能低下,如Prader-Willi 综合征和 Laurence-Moon-Bardet-Biedl 综合征。
2. 垂体疾病
(1) 垂体功能不足:由于肿瘤、感染、梗死、手术、放射和肉芽肿性病变等影响垂体功能所致。血清性激素检测睾酮水平低下伴促性腺激素低下或正常偏低。全垂体功能障碍者,血清皮质激素低下,FSH 和生长素水平也低下。
(2) 高泌乳素血症:原发性高泌乳素血症常见于垂体腺瘤。泌乳素过高会引起 FSH、LH 和睾酮水平降低,导致性欲丧失、勃起功能障碍、男性乳腺增生和生精障碍等。
3. 内源性或外源性激素异常
(1) 雌激素和(或)雄激素过多:外源性雄激素增多常见于口服激素、先天性肾上腺增生、有激素活性的肾上腺肿瘤或睾丸间质细胞肿瘤。过度肥胖、肝功能不全是雌激素增多的常见原因,还与一些能分泌雌激素的肿瘤如肾上腺皮质肿瘤、睾丸支持细胞(Sertoli cell)瘤或间质细胞瘤有关[10]。
(2) 糖皮质激素过多:能抑制 LH 分泌,导致精子发生、成熟障碍。多见于库欣综合征(Cushing’ s syndrome)或医源性摄入增加。
(3) 甲状腺功能亢进或减退:甲状腺功能的平衡通过垂体和睾丸两个层面来影响生精,甲亢或甲低可改变下丘脑激素的分泌和雌/雄激素比值,甲状腺功能异常约占男性不育病因的 0.5%[11]。
(二)睾丸性因素
1. 先天性异常
(1) 染色体或基因异常:不育男性约 6%存在遗传物质异常,随着精子总数降低该比例逐渐增高,精子总数正常者中染色体或基因异常者为 1%,少精子症患者中为 4%~5%,无精子症患者中比例最高达 10%~15%。
1)克氏综合征(Klinefelter’s syndrome):又称先天性睾丸发育不全症,外周血染色体核型为性染色体非整倍体异常,90%为 47,XXY,10%为 47,XXY/46, XY 嵌合型。其特点是睾丸小、无精子及血清促性腺激素水平增高等。
2)XX 男性综合征(XX male syndrome):又称性倒错综合征,是由于 Y 染色体上性别决定基因(SRY)在减数分裂时易位到 X 染色体,但控制生精的基因(AZF)仍在 Y 染色体,导致无精子症[12]。
3) XYY 综合征(XYY syndrome):是由于父亲精子形成的第二次减数分裂过程中 Y 染色体没有分离而受精造成的结果。
4) Noonan 综合征(Noonan syndrome) :又称男性 Turner 综合征,染色体核型大部分为正常 46,XY,少数为 45, X0 或嵌合型(45, X0/46, XY)。
5)Y 染色体微缺失:约 15%无精子症或重度少精子症患者存在 Y 染色体微缺失。常见的微缺失有:AZFa,AZFb,AZFc。
(2) 隐睾:是小儿极为常见的泌尿生殖系统先天畸形,早产儿发病率约30%,新生儿 3.4%~5.8%,1 岁时约 0.66%,成人为 0.3%[13]。
(3) 雄激素功能障碍:主要为雄激素不敏感综合征和外周雄激素抵抗。前者主要为雄激素信号传导过程中某一环节出现异常,后者包括 5α-还原酶缺乏和雄激素受体异常。
(4) 其他较少见的综合征:肌强直性营养不良(myotonic dystrophy, MD)、无睾丸症(vanishing testis syndrome )、唯支持细胞综合征(stertoli-cell-only syndrome, SCOS)等。
2. 生殖腺毒素 常见有射线、药物、食物、生活和工作环境因素等。
3. 全身性疾病 常见引起不育的系统性疾病包括肾衰竭、肝硬化与肝功能不全、镰形细胞病等。
4. 感染(睾丸炎) 青春期后的流行性腮腺炎 30%合并睾丸炎,常为单侧, 双侧发病率为 10%~30%,睾丸萎缩是最常见的严重后果。
5. 睾丸创伤和手术 睾丸创伤除导致睾丸萎缩外,还可激发异常免疫反应, 两者均可导致不育。睾丸血管、输精管道的医源性损伤也会导致不育。
6. 血管性因素 精索静脉曲张在不育症患者中的发病率近 40%,详见《精索静脉曲张诊断与治疗指南》。
7. 睾丸扭转 可引起睾丸缺血性损伤,损伤程度与缺血程度和持续时间有关,一侧扭转可引起对侧睾丸发生组织学变化。
8,免疫性因素 由于自身抗精子抗体阳性导致男性不育症。
(三)睾丸后因素
1. 输精管道梗阻 输精管道梗阻是男性不育的重要病因之一,梗阻性无精子症在男性不育患者中为 7%~10%。
(1) 先天性梗阻:梗阻可发生于输精管道的任何部位,从睾丸网、附睾、输精管直到射精管开口。
1) 囊性纤维化(cystic fibrosis, CF):属常染色体隐性遗传病,几乎所有 CF男性患者都伴有先天性双侧输精管缺如(congenital bilateral absence of the vas deferens, CBAVD)。
2) 杨氏综合征(young’s syndrome):主要表现三联症:慢性鼻窦炎、支气管扩张和梗阻性无精子症。生精功能正常,但由于浓缩物质阻塞附睾管而表现为无精子症,手术重建成功率较低。
3) 特发性附睾梗阻:罕见,1/3 患者存在囊性纤维变性基因突变,可能与囊性纤维化有关。
4) 成人多囊肾疾病(adult polycystic kidney disease, APKD):属常染色体显性遗传病,患者体内脏器多发性囊肿,当附睾或精囊腺有梗阻性囊肿时可导致不育。
(2) 获得性梗阻:主要为生殖系统感染、输精管结扎切除术、医源性输精管损伤及感染所致射精管口梗阻等。而疝修补术应用补片后可出现输精管周围炎症反应导致输精管梗阻。
(3) 功能性梗阻:干扰输精管和膀胱颈部神经传导的任何因素都可导致不射精或逆行射精,常见原因有神经损伤和服用某些药物等。
2. 精子功能或运动障碍
(1) 纤毛不动综合征(immotile cilia syndrome):是由于精子运动器或轴突异常而导致精子运动能力降低或丧失。
(2) 成熟障碍:常见于输精管结扎再通术后。由于结扎后附睾管内长期高压损伤附睾功能,再通术后精子通过附睾时未获得正常的成熟和运动能力,导致精子总数正常,但精子活力低下。
3. 免疫性不育 2%~10%的不育与免疫因素有关,抗精子抗体(antisperm antibody, AsAb)是免疫性不育的重要原因。常见原因有睾丸外伤、扭转、活检、感染或输精管梗阻、吻合手术后等[14]。
4. 感染 8%~35%的不育与男性生殖道感染有关[15],主要为感染导致输精管道梗阻、抗精子抗体形成、菌精症、精液白细胞增多症以及精浆异常。
5. 性交或射精功能障碍 性欲减退、勃起功能障碍和射精功能障碍是男性不育症的常见原因;尿道下裂等解剖异常由于射出精液距宫颈过远而导致不育;糖尿病、膀胱尿道炎症、膀胱颈部肌肉异常、手术或外伤损伤神经均可导致不射精或逆行射精;不良的性习惯如性交过频、使用润滑剂等也会影响生育。
(四)特发性病因
特发性不育是指男性不育症找不到明确病因者,其影响生殖的环节可能涉及睾丸前、睾丸、睾丸后的一个或多个环节。目前倾向与遗传或环境因素等相关。
三、男性不育症诊断
(一)诊断方法
1. 病史 采写男性不育病史要全面了解家族史、婚育史、性生活史和其他对生育可能造成影响的因素,还要简要了解女方病史,记录患者个人信息。
(1) 主诉及现病史情况
1) 主诉:多为结婚后(同居)×年,未避孕××年(月)未育。
2) 婚育史:需了解结婚(同居)时间及尝试怀孕的时间;应详细了解既往生育史,包括既往使其他异性受孕情况。注意在私密场合探询,以获得可靠病史。还应了解女方基本生育力情况,如年龄、月经是否规律、常规检查情况,特别要了解女方输卵管检查通畅情况。
3) 性生活史:需了解性生活频率、质量及能否在阴道内射精。
4) 生育力检测及治疗史:要详细询问并记录既往生育力检测和治疗情况, 尤其是精液分析结果。注明既往治疗方案、是否正确实施及治疗结果等细节。
(2) 既往史:主要包括生长发育史、过去疾病史、传染病史、用药史等。要重点询问与生育相关的疾病和因素,包括炎症、发热史、对生育有影响的不良生活习惯、环境与职业因素等。高温环境作业者、有电磁辐射与放射线接触史者、长途驾驶员等对生育有一定影响[16]。
(3) 家族史、遗传性疾病史:父母身体状况、有无近亲结婚,有无遗传性疾病史,母亲生育情况及兄妹健康生育情况等。
(4) 过敏史、手术外伤史:有药物、试剂等过敏史者,选择进一步治疗方案时要考虑。了解泌尿生殖系统手术外伤史,还要注意有无骨盆外伤史等。
(5) 配偶病史:主要了解月经史、生育史、避孕史(女方是否曾使用宫内节育器[17])、妇科疾病和其他可能影响生育的疾病史和生活工作因素等。
2. 体格检查
(1) 体检应在温暖的房间内进行,暴露良好并注意保护患者隐私。
(2) 全身检查:重点应注意体型及第二性征。测量身高、体重及血压[18], 注意体态和外形(躯干肢体比例,第二性征,体毛分布),有无男性乳房发育等。
(3) 生殖系统检查: 应注意有无外生殖器官器畸形,还要检查附睾和输精管有无结节、疼痛或缺如等。嘱患者做 Valsalva 动作以判断是否存在精索静脉曲张并予分度。
(4) 直肠指诊:主要检查前列腺情况。精囊一般不易触及,如有明显触痛或其他异常发现,需进行经直肠超声检查。
(5) 其他检查:射精功能障碍可进行神经反射检查,具体参阅《早泄诊断与治疗指南》。
3. 辅助检查
(1) 常规项目
1) 精液分析:包括分析精子和精浆特征与参数,结果会受许多因素干扰, 只能提供判断男性生育力的可能性。仅通过一份精液标本的评估无法确定一位男性精液质量的特征。进行 2~3 次精液分析有助于获取基线数据[19]。
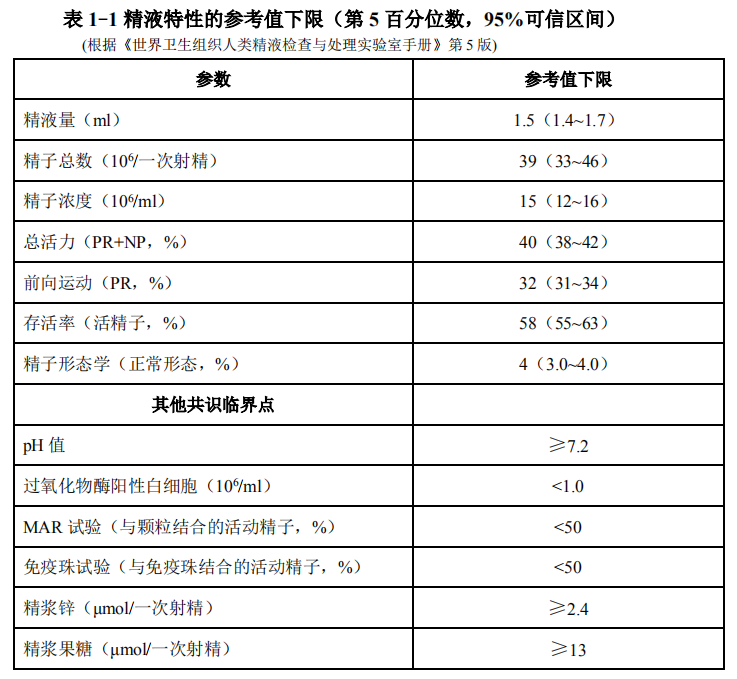
世界卫生组织 2010 年公布了《世界卫生组织人类精液检查与处理实验室手册》(第 5 版,2010 年)[20]标准化程序进行精液分析和质量控制(表 1-1)。无精子症精液分析应特别慎重,至少要进行 3 次以上严格的精液采集和分析以确诊
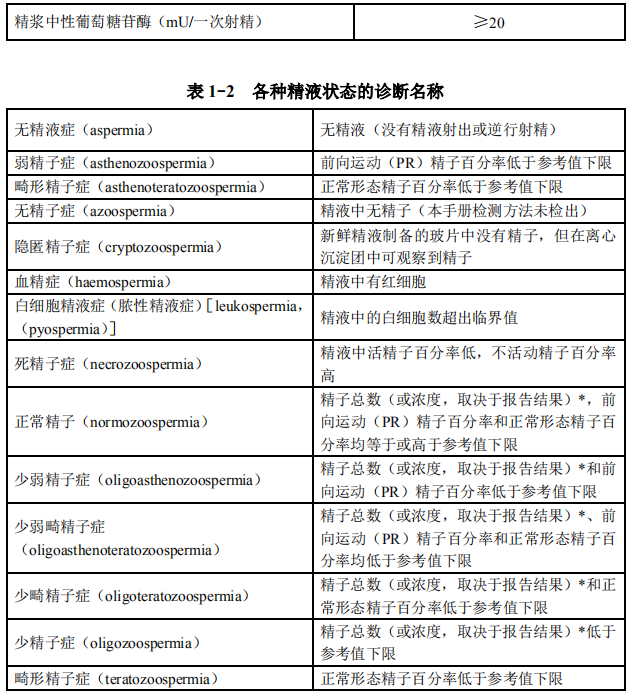
[21]。如精液分析报告提示圆形细胞增多、白细胞增多等均需进一步检测(表 1-2)。
*应该总是优先考虑精子总数,因为精子总数优于精子浓度
由于缺乏国人精液参数的正常参考值范围,《世界卫生组织人类精液检查与处理实验室手册》第 5 版的相关推荐参考值在一定范围内尚有争议,总体而言不
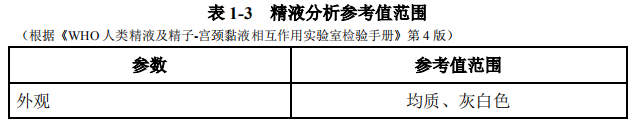
少地方存在第 4 版[22]与第 5 版同时并存的局面。尽管如此,第 5 版提出的有关精液分析质量控制的概念、方法值得推荐和参照执行(表 1-3)。
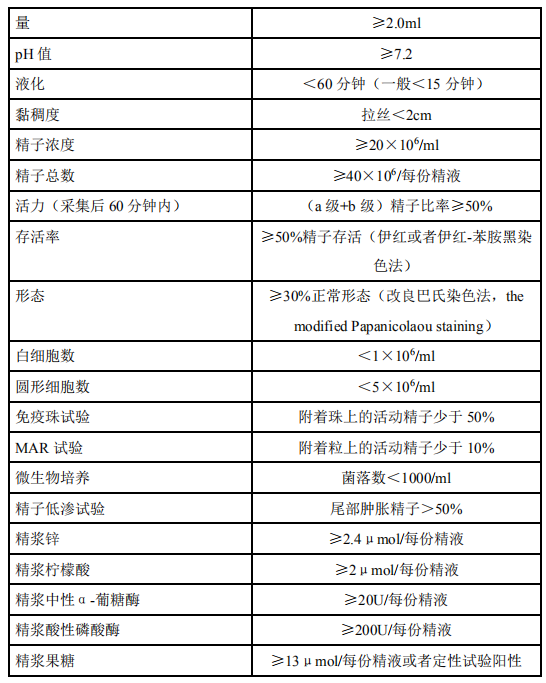
注:由于缺乏国人精液参数的正常参考值范围,临床上建议仍沿用 WHO 第 4 版参考值标准(1999 年)
2) 生殖系统超声:根据患者体检及精液分析情况,考虑合并隐睾、精索静脉曲张、肿瘤、鞘膜积液、输精管道梗阻等情况时,可进行超声检测,包括阴囊超声及经直肠超声。阴囊超声主要检测双侧睾丸、附睾、精索静脉及近端输精管。通过测量睾丸上下径、左右径、前后径,并使用公式校正后计算睾丸容积(容积=睾丸上下径×左右径×前后径×0.7 )。如发现无精子症患者有双侧附睾细网状改变,考虑存在附睾或输精管的梗阻[23]。对于精索静脉曲张,可得到明确诊断。经直肠超声主要检测前列腺、精囊、输精管和射精管。可发现的一系列表现包括,射精管囊肿、射精管扩张(宽度大于 2mm)、射精管结石或钙化、精囊扩张(前后径大于 15mm)以及精囊发育不良或不发育(前后径小于 7mm)、输精管发育不全和前列腺钙化灶/不均质等。
(2) 推荐项目:除了常规项目,还可选择下列有关检查:
1)抗精子抗体(AsAb)检测:大量研究资料表明 10%~30%的不育患者血清或精浆中可检测到 AsAb[24]。具体的检测方法参见《男科实验室检查手册》。 2)性激素检测:性激素检测主要针对可疑生精功能受损、性腺功能低下及
性功能(性欲)异常的患者进行。
3) 外周血染色体核型等遗传学检测:对于有家族史、怀疑有染色体异常( 如 Klinefelter’s 综合征)或精液分析异常(特别是严重少、弱、畸精子症)患者,可进行染色体核型分析等遗传学检测。对严重少弱精子症及无精子症患者建议同时进行 Y 染色体微缺失检测。
4) 支原体、衣原体检测:已有较多研究[25,26]支持支原体、衣原体感染是导致精子浓度、活力及形态异常的原因之一。对精液参数异常患者,尤其是精液白细胞增多、合并尿道分泌物的患者应进行支原体和衣原体检测。
5) 精子存活率检测:主要用于反映活精子所占比例,可用染色排除法或低渗肿胀实验来鉴定。
6) 射精后尿离心检测:主要针对无精液症或精液量少者,根据射精后尿离心检测是否找到精子可辅助诊断逆行射精或部分逆行射精。
7) 精子-宫颈黏液体内试验:即性交后试验,其目的是测定宫颈黏液中的活动精子数目,以及评估性交几小时后精子的存活状态。同时也可以用于评估男性或配偶 AsAb 阳性的意义[27]。特别当男方手淫取精困难,无法进行精液常规检查时,可以通过性交后试验来了解精液的状况。性交后 9~14 小时子宫颈内黏液中存在任何快速前向运动精子,可以排除宫颈因素以及男方或女方的精子自身免疫因素导致不育的可能。当观察到非前向运动精子显示颤动现象,提示宫颈黏液中或者精子表面可能存在 AsAb。但也有观点认为,性交后试验缺乏临床意义[28]。 8)精子-宫颈黏液体外试验:可应用几项体外穿透试验来详细评估精子-宫颈黏液相互作用。通常在性交后试验为阴性结果后才进行,并且使用供者精液和供者宫颈黏液作为对照,进行交叉试验可以提供更多的信息。
9) 精子处理技术:根据每份精液的具体情况选择上游法或密度梯度法。
10) 诊断性睾丸/附睾取精术:无精子症患者因诊断和治疗需要,可考虑实施诊断性睾丸/附睾取精术。常用的几种手术方法:
开放手术活检:剪切下的睾丸组织,放入 Bouin 氏液中而不能使用甲醛。应同时做涂片细胞学检查以了解精子存在情况。
经皮睾丸穿刺活检术:比睾丸开放活检更为简便,但获取的标本量少,可能无法进行病理组织学检查。
睾丸细针精子抽吸术(testicular sperm aspiration,TESA):有研究[29]认为使用睾丸细针抽吸术损伤小,且可以进行多点抽吸,而另一些研究[30]则认为该技术不像开放活检那样得到有效的病理诊断。
其他方法包括,经皮附睾精子抽吸术(percutaneous epididymal sperpaspiration, PESA )、显微外科附睾精子抽吸术( microscopic epididymal sperpaspiration,
MESA)、显微外科睾丸切开取精术。
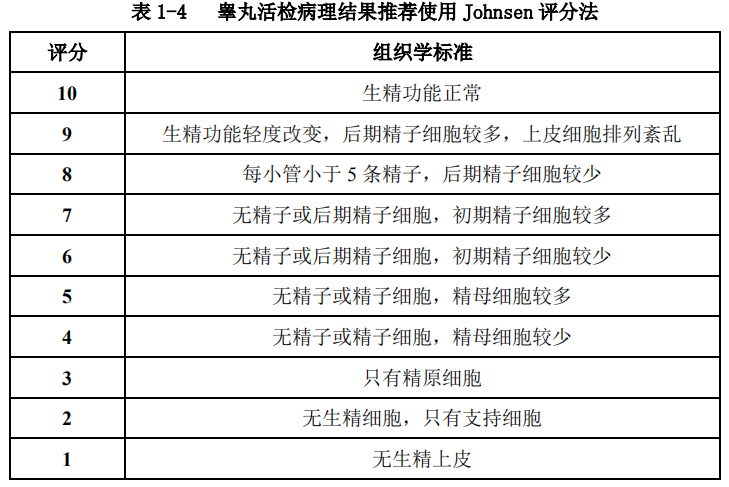
任何一种手术方法获得的精子可考虑超低温冷冻保存以备 ICSI 使用。睾丸活检病理结果推荐使用 Johnsen 评分法见表 1-4[31] 。
11) 其他:血常规、肝肾功能、血糖、血脂、甲状腺素等血液检查有助于发现某些可能对生育造成影响的全身疾病。头颅摄片用以排除垂体肿瘤和颅内占位性病变,尤其在无法解释的 PRL 水平持续增高或者促性腺激素不足病例中更有必要,这些患者可能还需要进一步检查,如 GnRH 测定和其他垂体激素功能检查测定。以往为明确输精管道通畅性而进行的输精管精囊造影,现认为其操作本身及造影剂可能会导致输精管道的进一步梗阻,已不再使用。
(3) 可选择项目
1) 阴囊红外线温度测定法:亚临床型或 I 度精索静脉曲张等患者,可进行该检测。
2) 输精管探查术:为了鉴别梗阻性无精子症或睾丸生精功能障碍无精子症,明确梗阻部位、范围及梗阻原因,可选择输精管探查术。该操作必须在同时准备进行输精管道再通手术的情况下实施。
3) 活性氧(reactive oxygen species, ROS)检测:ROS 的检测对于预测精子是否会因氧自由基的攻击而受损伤有着重要的意义[32]。
另外,人卵透明带结合试验、顶体反应、CASA 检测精子形态等试验尚处于探索阶段,主要用于科研,可供临床选用。
(二)诊断分类
男性不育症可简要分为4大类16小类:
1. 性交和/或射精功能障碍
2. 精子和精浆检测异常与否
(1) 不明原因性不育;
(2) 单纯精浆异常;
(3) 男性免疫性不育。
3. 病因明确
(1) 医源性因素;
(2) 全身性因素;
(3) 先天性异常;
(4) 获得性睾丸损伤;
(5) 精索静脉曲张;
(6) 附属性腺感染性不育;
(7) 内分泌原因。
4. 其他病因
(1) 特发性少精子症;
(2) 特发性弱精子症;
(3) 特发性畸形精子症;
(4) 梗阻性无精子症;
(5) 特发性无精子症。分别叙述如下:
1. 性交和/或射精功能障碍 勃起功能障碍请参阅《阴茎勃起功能障碍诊断与治疗指南》;射精功能障碍引起的不育包括不射精、逆行射精和严重早泄请参阅
《早泄诊断与治疗指南》。
2. 精子和精浆检测异常与否
(1) 不明原因性不育:指病史、体检以及精子和精浆检测都无异常发现的男性不育患者。
(2) 单纯性精浆异常:指患者精液分析的精子检测指标正常,但精浆检测有异常发现。
(3) 男性免疫性不育:大量研究资料表明10%~30%的不育不孕者血清或精浆中可检到AsAb,但血清AsAb是否有临床意义还存在争议[24, 27,28]。
3. 病因明确的男性不育症 这些诊断首先要求患者必须有正常的勃起和射精能力,精浆检测正常,但精子指标有异常。根据病史、生殖腺毒素接触史、体检和辅助检查可以得出明确原因。
(1) 医源性因素:由于用药、放疗或者手术因素(如某些手术可能导致逆行射精或不射精、损伤输精管造成部分或完全性输精管梗阻)导致的男性不育。
(2) 全身性原因:消耗性疾病和生殖腺毒素接触导致精子质量异常、生育力降低。
(3) 先天性异常:由于睾丸下降不全、先天性输精管缺如或其他先天生殖管道发育异常、染色体核型异常等遗传性病因导致的精子质量异常乃至无精子
症。
(4) 获得性睾丸损伤:腮腺炎、梅毒、结核引发睾丸炎导致精子质量下降乃至无精子症。睾丸外伤、睾丸肿瘤也会降低男性生育力。
(5) 精索静脉曲张:由于精索静脉扩张、扭曲、瓣膜功能障碍,导致静脉血液回流障碍,影响睾丸功能,出现精液参数和精子功能异常引起男性不育。
(6) 附属性腺感染性不育:是导致男性不育的可能原因之一,但并非绝对会导致生育力降低或不育。关于前列腺炎与不育的关系仍存在争议。
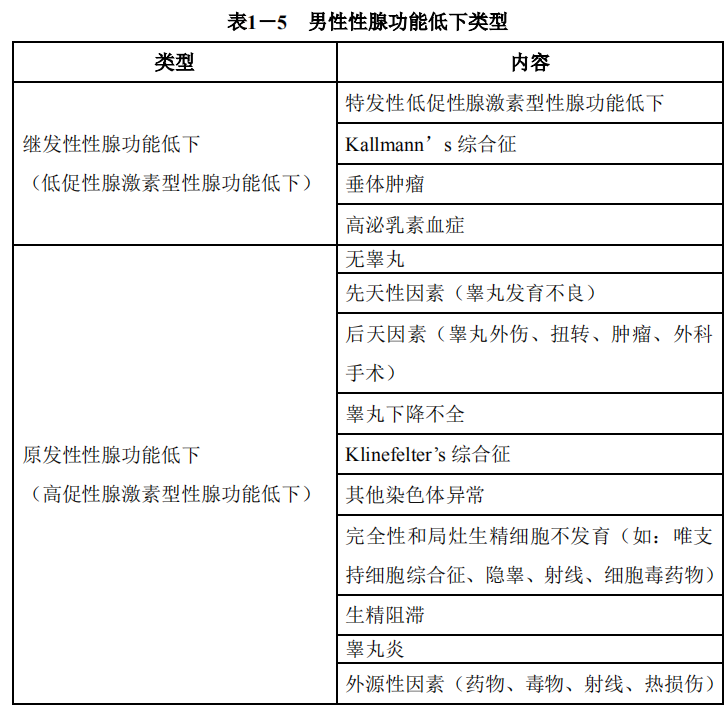
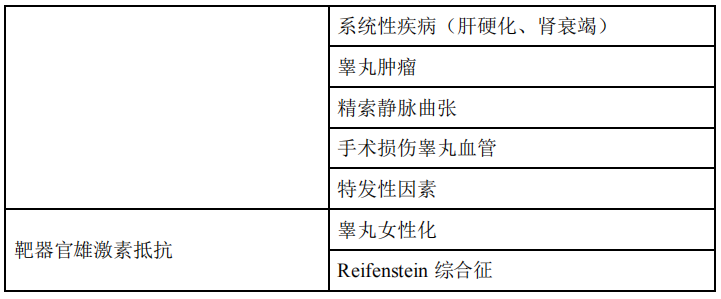
(7) 内分泌原因:下丘脑-垂体-性腺轴系任何一个环节的异常均可导致睾酮水平降低即性腺功能低下,引起精液异常而降低生育力,有的会出现性功能障碍而导致男性不育。性腺功能低下主要包括:继发性性腺功能低下和原发性性腺功能低下。具体见表1-5。
1. 其他病因
(1) 特发性少-弱-畸形精子症:仅有精液分析异常而没有上述各种异常, 临床可诊断为特发性少精子症、特发性弱精子症或特发性畸形精子症。有的同时具备以上三个诊断的两个或三个。
(2) 梗阻性无精子症:指由于双侧输精管道梗阻导致精液中未见精子和生精细胞。
(3) 特发性无精子症:临床上均表现为非梗阻性无精子症,其病因不明, 诊断往往依靠排除法。
(三)诊断程序
根据患者的病史、生殖腺毒素接触情况、体格检查以及辅助检查结果等,明确发病部位(睾丸前、睾丸性或睾丸后不育),按照诊断流程可以得出初步诊断
(详见附录 1、附录 2)。
(四)诊断注意事项
(1) 男性不育的治疗成功与否,只能间接通过配偶临床妊娠来评估。故其诊断治疗方案的选择,要遵照循证医学原则,参考女性年龄与生育力状况。
(2) 按照精液参数对男性不育症的分类,如分为无精子症、少弱精子症或畸形精子症,这只是对精液参数的基本评估,不能据此对男性不育做出病因诊断。
(3) 对男性不育症要分类诊断,对因处理。
如果精液分析结果异常,则需结合病史进一步分析原因。在精液物理参数异常时,尤其要重视询问患者标本采集时的情况,是否有部分精液遗漏,禁欲天数,运送情况等。如精液量少,pH 值低于 7.0,需考虑射精不完全、射精管梗阻、部分逆行射精等情况,如精液中未查及精子,还要排除先天性双侧输精管缺如等。
(五)男性生育状况评估
(1) 近 90%的夫妇在 12 个月内可自然受孕。曾认为 12 个月经周期或 1 年未
避孕的性生活之后,或 35 岁以上妇女在 6 个月经周期或 6 个月未避孕的性生活之后仍未怀孕才考虑进行男性不育症的评估[33]。现在观点认为男性生育状况评估随时可以进行,主要取决于夫妇对生育的要求,尤其对有家族原因或怀疑夫妇任何一方有异常时,无需尝试自然怀孕 1 年以上即可以接受评估[34]。
(2) 男性生育状况的评估应该包括基本项目及特殊项目,前者主要用于一般筛查,包括病史、体检、精液分析;后者主要用于确诊和疾病分类,根据基本项目的检测结果及患者的不同要求,包括生殖系统超声、内分泌激素检测、精浆检测、染色体检测及睾丸取精术等。
(3) 由于男性生育状况的波动变化性,评估也应有时效性和空间性。不同实验室、不同时间、治疗的不同阶段都可能影响评估结果。因此,建议男性生育状况的准确评估应该是在没有治疗干预(尤其是药物治疗)的前提下,由具备合格质控系统和资质的单一实验室在 3~6 个月内进行,并进行严密随访。
(4) 对初次就诊的患者,如果精液分析检测结果正常,排除患者夫妇的性生活异常,完成女方生育能力评价后,考虑到精液参数波动性,一次检测可能存在偏差,可继续尝试怀孕 2 个月, 2 个月后再进行一次精液常规分析。
(5) 如近期有感染、发热、劳累者,考虑身体状况导致的精液质量异常,需在身体状态恢复后再次复查。发热达 39℃以上者,对睾丸生精功能影响较大, 建议 2 个月后复查精液。
精液分析参考值范围的准确定义是获得生育所必需的最低水平,因此根据精液分析结果可初步了解男性的生育力状况。如检测结果低于参考值水平,提示有不育可能;高于参考值水平,则提示具有生育能力。但一些不育患者的检测结果可高于最低值,而有些已生育者的检测结果可却低于最低值。
四、 男性不育症治疗
(一)一般治疗
1. 不育夫妇双方共同治疗 不育症是诸多病因作用的结果,生育力与夫妇双方有关。因此,治疗时要特别注意夫妇共同治疗。即使是不射精症、无精子症等不做治疗不能获得生育的绝对不育男性,在治疗前也应对女方的生育力进行评估。
2. 宣传教育 男性不育症的发生与生活、工作、环境、社会、心理等许多因素有关,而且会影响到患者心理、婚姻、家庭等。因此,治疗时要进行生殖健康知识教育。为预防男性不育还应着重注意以下几点:
(1) 预防性传播性疾病;
(2) 睾丸下降不完全者,应在2岁以前作出相应处理;
(3) 安全的环境,避免接触对睾丸有害的因子及化学物品。
(二)内科治疗
明确男性不育的诊断后,在选择内科治疗或外科治疗之前必须对女方做详细生育力评估。
内科治疗包括预防性治疗和药物治疗,后者可分为特异性治疗、半特异性治疗和非特异性治疗三类。
1. 预防性治疗
(1)感染性不育的预防: 男性感染性不育的机制尚未阐明,但研究表明, 大肠杆菌感染的前列腺炎,生殖系统支原体、衣原体感染,对精子活力有明显损害[35]。
感染性不育的预防原则为:
1) 避免婚外性接触;
2) 有泌尿生殖系统感染症状者应进一步进行支原体和衣原体检测;
3) 夫妇双方有一方存在衣原体、支原体感染者,应特别注意预防交叉感染。除进行治疗外,在性生活时需使用安全套,直至夫妇双方均消除感染。
(2)使用化疗药物致睾丸生精功能障碍的预防: 睾丸肿瘤和霍奇金淋巴瘤等疾病采用的化疗可引起睾丸损害,使睾丸生精功能发生障碍。对于必须接受化
疗,同时又希望生育的肿瘤患者,可在化疗前进行精子冷冻,预防因化疗造成生精功能低下而导致的不育[36,37]。冷冻的精子可复苏后进行人工授精。
1. 药物治疗 病因诊断明确,有针对病因的治疗性措施者,治疗效果则较为满意,如促性腺激素治疗;脉冲式 GnRH 治疗;促进内源性促性腺激素分泌;其他内分泌疾病治疗等。当病因明确但这种病因引起不育机制尚未阐明,治疗效果往往不够满意。
(1) 非特异性治疗:由于特发性男性不育症的患者缺乏明确的病因,针对这部分患者往往采用经验性药物治疗。许多研究发现,无法证实当前可选用的经验性药物治疗对特发性男性不育症患者具有确切疗效[38]。但不可否认,经验性药物治疗在临床上仍广泛使用,某些药物也确实对部分患者有一定治疗作用。在药物治疗过程中应尽可能注重用药适应证和治疗时机的选择,如果准备进行经验性药物治疗,则药物使用的时间不应少于 3~6 个月,这样可以覆盖一个完整的精子生成周期。目前临床常用的经验性治疗药物介绍如下:
1)抗雌激素类药物:是治疗特发性少精子症最常用的药物之一。这类药物通过阻断雌激素的负反馈抑制效应而促进垂体分泌促性腺激素,继而可以提高血清中 FSH 和 LH 水平。主要能刺激睾丸间质细胞产生睾酮,其次也促进精子生成。抗雌激素类药物相对便宜,口服安全,然而疗效仍存在争议。临床常用的抗雌激素药物为克罗米芬和他莫西芬。克罗米芬(clomiphene)是合成的非甾体类雌激素,表现出较显著的雌激素效应[39]。常用 50mg/d,口服。必须监测血促性腺激素和血睾酮以保证睾酮在正常范围。他莫西芬(tamoxifen, 三苯氧胺)的雌激素效应较克罗米芬弱,剂量范围 10~30mg/d,口服[40]。
2) 雄激素治疗:以往雄激素制剂用于特发性不育的治疗常有两种方案:大剂量反跳治疗和小剂量持续给药。如果下丘脑-垂体-性腺轴完整,雄激素治疗将降低睾丸内睾酮浓度。采用大剂量外源性睾酮治疗将抑制垂体释放 LH,进而降低睾丸内睾酮水平。反跳治疗是希望停止雄激素治疗后通过性腺轴的反跳改善精子生成。临床研究已发现这种方法对特发性不育无明显疗效。小剂量持续治疗目的是通过补充睾酮来刺激精子生成,临床研究结果发现也无明显疗效[41]。
目前文献基本否定外源性雄激素补充治疗男性不育的作用。欧洲泌尿外科学会的男性不育诊疗指南也明确表明外源性睾酮补充治疗对特发性男性不育症并
无益处[38]。美国泌尿外科协会 2012 年一项基于会员的特发性男性不育症药物治疗选择调研发现,仍有约 25%医师使用外源性睾酮进行男性不育症的治疗,并表示“这一结果令人担忧”[42]。
2) 抗氧化治疗:精液中过多活性氧(ROS)可通过氧化应激作用导致脂质过氧化而损伤精子,而精浆中的抗氧化剂具有清除 ROS 的作用,可防止精子受损。基于这一原理,临床口服抗氧化剂可减轻氧化应激损伤并改善男性生育力[43]。常用的抗氧化剂包括维生素 E、维生素 C、辅酶 Q10 以及乙酰半胱氨酸等[44]。但疗效不确切。
3) 胰激肽释放酶:研究认为胰激肽释放酶可刺激精子生成,提高精子活动力。其他机制还包括提高精子代谢、增加睾丸血供、刺激睾丸支持细胞功能、提高性腺输出管道的功能等。但疗效不确切[45]。
4) 己酮可可碱(pentoxifyline):属于甲基黄嘌呤的衍生物,作为一种非选择性磷酸二酯酶抑制剂,能阻断cAMP转变为AMP,增加细胞糖酵解和ATP的产生,常用于血管疾病的治疗。用于治疗特发性不育的治疗机制是可能会改善睾丸的微循环、减少cAMP的降解、增加细胞内糖分解和ATP的合成并因此促进精子代谢和其他功能。也有报道可改善精子浓度、活力、正常形态精子百分比。常用剂量: 1200mg/d[46,47]。
5) 重组人生长激素(recombinant huamn growth hormone,rh-GH): rh -GH可以增强睾丸间质细胞功能并增加精液量;rh-GH可刺激释放胰岛素样生长因子-1(IGF-1),IGF-1可作为精子生长过程中自分泌/旁分泌生长因子而发生作用 [48]。剂量为2~4IU/d,皮下注射。目前尚无令人信服的大规模研究结果。
6) 左旋肉碱(L-carnitine):又称左卡尼汀。人体内的左旋肉碱在附睾运送 程中增加精子能量并提高精子活力,也有一定抗氧化能力。目前,左卡尼汀作为 2g/d,每日2~3次,口服,疗效不确切。
7) 其他药物:氨基酸、锌、硒、维生素 A、前列腺素合成酶抑制剂等均有报道,可能有助于提高精液参数和受孕率,但均缺乏足够的说服力[50,51]。
(2) 半特异性治疗: 许多引起不育的疾病,机制尚未完全阐明,且缺乏正确的诊断方法,对这些疾病的治疗效果还未被肯定。代表性的半特异性治疗包
括使用抗生素治疗男性附属性腺感染以及针对 AsAb 的治疗。
1) 男性附属性腺感染的治疗:对于明确的生殖道感染如淋病,可根据其明显的临床症状和细菌学检查确诊。采用常规方法进行治疗。对怀疑有亚临床型生殖道感染的,如支原体感染,可使用阿奇霉素、多西环素等治疗。而慢性前列腺炎和慢性附睾炎是一种慢性且易于复发的疾病,除试用抗炎治疗外还需注重生活方式的改善。
2) AsAb 的治疗:引起 AsAb 有许多不同触发机制,并可产生许多不同种类的抗体。在某些生殖道梗阻的病例,单侧、双侧性或部分性梗阻都可引起 AsAb,这种情况下应采用相应的外科治疗。而感染所致的 AsAb 应使用抗生素治疗。无梗阻或感染的 AsAb 可试用小剂量免疫抑制剂治疗,如倍他米松等。对于部分患者可选择精子洗涤及夫精宫腔内人工授精,以克服子宫颈黏液的屏障作用。但疗效仍存在争议。
(2) 特异性治疗: 主要针对病因诊断明确的患者,如内分泌功能紊乱引起的男性不育等。通过针对病因的特异性治疗,多数治疗效果比较满意。
1) 促性腺激素低下的性腺功能减退症:主要治疗药物为人绒毛膜促性腺激素
(hCG)和人绝经期促性腺激素(hMG),适用于:各种低促性腺激素型性腺功能障碍。促性腺激素替代治疗前应常规行性激素检测,排除高泌乳素血症。激素替代治疗可用外源性促性腺激素或 GnRH。hCG 和 hMG 用于治疗特发性少精子症,疗效不确切[52]。低促性腺激素型性腺分泌不足的治疗:hCG 2000IU,肌内注射,2~3次/周。为了促进部分先天性HH征患者的睾丸发育,可加用hMG或纯的重组人FSH。FSH 37.5~75IU,肌注,3次/周,共3个月。当精子浓度接近正常时停用FSH。
单独LH缺乏时,hCG治疗可提高睾丸内和血清睾酮水平。
单独 FSH 缺乏时,可用 hMG 或纯的重组人 FSH 治疗,也可用克罗米芬治疗。
值得注意的是,hCG/hMG 的长期大剂量应用由于不能模拟 GnRH 脉冲式分泌后出现的 LH/FSH 生理性脉冲,因而发挥不了最佳效果。加之所用剂量均为药理剂量,长期使用会使垂体和睾丸上的受体数目减少而变得对外源性促性腺激素不敏感。有研究报道使用“人工下丘脑”技术,即 GnRH 脉冲治疗,可弥补促性腺激素治疗的不足。Kallmann 综合征和特发性低促性腺激素型性腺功能减退症, 主要是由于不能形成 GnRH 脉冲,因而采用此法治疗最为合适,但价格昂贵, 且需一种特殊的输液泵将 GnRH 类似物脉冲式输入人体内,治疗时间往往长达一年。
1) 高泌乳素血症:排除垂体肿瘤后采用多巴胺受体激动剂-溴隐亭(bromocriptine) 治疗。剂量范围:2.5~7.5mg/d,2~4 次/天,疗程 3 个月,效果较好。卡麦角林(cabergoline)的疗效与溴隐亭相仿,服药次数和副反应较少。
2) 甲状腺功能减退症:补充甲状腺素可能改善生育力。
3) 糖皮质激素:继发于先天性肾上腺皮质增生的男性不育症可用糖皮质激素治疗,减少ACTH和外周血雄激素水平,进而促进促性腺激素释放、睾丸内雄激素合成与释放和精子生成。不推荐对AsAb患者使用皮质激素治疗,可能会导致严重的副作用和其他未知后果。
3 .合并性功能障碍的综合治疗策略 导致男性不育的性功能障碍包括心理性和器质性因素引起的勃起障碍和(或)性交频率不足、射精障碍(性生活正常, 因功能性或解剖原因,如尿道下裂、不射精或射精于阴道外导致)、逆行射精等。在选择治疗策略前,应明确出现性功能障碍的原因。许多患者往往由于生育压力,出现“排卵期综合征”,即配偶排卵期出现勃起障碍、不射精等性功能障碍, 而其他时间均正常。应尽可能安排夫妇双方共同参与诊治。
(1) 勃起功能障碍(erectile dysfunction, ED):参考《阴茎勃起功能障碍诊断与治疗指南》进行诊治,必要时可使用 ART 治疗先解决生育问题。有报道口服 PDE5 抑制剂对精子活力和顶体反应均有一定程度影响,尚有争议,且体外试验和体内试验的研究结果不一致。总体来说,受孕期间使用 PDE5 抑制剂是安全的。
(2) 严重早泄:参考《早泄诊断与治疗指南》进行诊治:有研究报道使用选择性 5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor, SSRI)治疗可影响精液参数,包括精子浓度及活力[53]。因此,在使用该类药物治疗期间需密切监测精液情况或用药期间避孕。治疗效果欠佳时可选择 ART 治疗先解决生育问题。
不射精症:具体可参考《早泄诊断与治疗指南》进行诊治。治疗效果欠佳时,可选择 ART 治疗先解决生育问题。
(3) 逆行射精:参考《早泄诊断与治疗指南》进行诊治。
(四)传统医学治疗
传统医学治疗男性不育症是我国的特色,有着悠久的历史。对于不育症,中医诊治讲究辩证论治,根据医者的望闻问切,来辩别患者的气血阴阳、表里虚实的异常,从而选择补肾、温阳、滋阴、益气、活血、疏肝、化痰、清利等方法进行治疗,除了中药治疗外,还有针灸、推拿等方法可供选择。一些不明原因不育症治疗,在无证可辩的情况下,可尝试中医补肾疗法。具体可参考中医药学会或中西医结合学会有关指南进行治疗。
(五)男性不育症患者配偶评价
应对不育男性的配偶进行全面评估,以便确定直接有效的治疗方案。
1. 一般情况 女性体重是影响生育能力的重要因素,过重或过轻均有可能影响正常排卵、改变对促性腺激素超促排卵的反应性,减少受孕机会、增加流产率, 还可能增加妊娠并发症和新生儿病死率及取卵手术的风险[57,58]。其他导致不孕的因素包括糖尿病、其他内分泌疾病或自身免疫性疾病。
2. 排卵评估 正常的排卵是指卵泡的破裂及卵子的排出。目前临床最常用的排卵评估是血清 LH 峰值测定与连续超声监测相结合。
3. 卵巢储备功能评估 卵巢对促性腺激素刺激的反应性以及多个卵泡能否同时发育是决定 IVF 成功的主要因素。这种反应性反映了卵巢功能或者称为“卵巢储备功能”。卵巢储备功能可以从以下几方面进行评估。
(1) 基础血清 FSH 水平:是评价卵巢储备及预测卵巢对促排卵反应性的最佳指标之一,并与妊娠率有相关性[59]。但对 IVF 治疗的预测价值极为有限[60] 。
(2) 年龄:随着年龄的增长,妇女生育功能逐步降低。确切原因尚不清楚,可能受多种因素影响,包括性交频率的改变、原始卵泡的减少、卵子质量下降、子宫病变以及部分染色体异常引起的流产。
(3) 超声检查:随着年龄增长,卵巢体积逐渐缩小。经阴道超声检查卵巢体积的方法快速、准确且具有很好的性价比。卵巢体积缩小是卵巢衰老的表现, 这一现象可能早于 FSH 水平的升高 [61]。
(4) 其他:FSH 水平与基础血清 E2 水平相结合可以提高预测生育力。其他指标包括血清抑制素 B、血清抗苗勒管激素等。
4. 盆腔输卵管因素 输卵管因素不孕占女性不孕的 14%[62]。了解输卵管通畅性及其功能对决定最佳治疗方案是至关重要的。输卵管通畅性检查首选子宫输卵管造影术(hysterosalpinography, HSG)。但输卵管通畅并不一定表示输卵管具有正常的功能,如果有盆腔感染或手术的病史,则需腹腔镜检查证实子宫-输卵管之间的关系,尤其是输卵管的蠕动功能及伞端的状态。
5. 子宫因素 子宫畸形、子宫肌瘤、宫腔粘连及子宫内膜息肉被认为是常见的与自然流产或反复流产有关的因素。评估宫腔状态的“金标准”是诊断性宫腔镜检查 [63]。
(六)辅助生殖技术
辅助生殖技术(assisted reproductive technology,ART),指运用各种医疗措施,使不孕不育夫妇受孕方法的统称,包括人工授精、体外受精-胚胎移植。其过程是采用非性交手段受孕的方式,需要临床医师和实验室技术人员等相关人员联合操作治疗男女不孕不育的重要手段。人类精子库与精子超低温保存也是辅助生殖技术的一部分。
1. 人类精子库与精子超低温保存 通过建立超低温冷冻技术,冷冻保存精子以治疗不育症,提供生殖保险[64]。根据精子的浓度和不同临床需求,采用冷冻管、冷冻麦管、冷冻环或人卵透明带等方法[65,66]。对精子进行冷冻储存时随着储存时间的延长,尤其是反复暴露在室温中,精子的存活率会逐渐下降。理想的储存时间应不超过 10 年。
推荐对下列患者进行生殖保险:由于恶性肿瘤、自身免疫性疾病需要化疗、放疗或手术治疗前。临床在治疗顽固性不射精症时,也可采用经直肠电刺激收集精液进行超低温保存。通过外科手术从睾丸、附睾或远端输精管取得的精子或睾丸组织,推荐进行超低温保存[67]。
2. 人工授精 是指男方通过体外排精,待精子液化加入培养液采用上游法或密度梯度离心法处理后注入女方的体内,使精子和卵子结合促使妊娠的一种治疗措施。
(1) 根据精子来源不同分为:夫精人工授精和供精人工授精。
(2) 根据精液注入女方体内的部位不同,主要分为:宫颈周围/宫颈管内人工授精和宫腔内人工授精。
3. 体外受精-胚胎移植(IVF-ET) 是一种避开输卵管的受孕方法,通过阴道 B 超将女方卵子取出放置在培养皿中,4~6 小时后将洗涤优化的精子加入其中,使卵子受精,形成受精卵,发育成囊胚需 72 小时,移植入女方的子宫腔内,
等待着床受孕。治疗主要包括 4 个过程:
(1) 超促排卵;
(2) 取卵;
(3) 体外受精;
(4) 胚胎移植。
4. VF-ET 衍生的辅助生殖技术
(1) 卵胞浆内单精子显微注射(intra-cytoplasmic sperm injection, ICSI):即将一个精子通过透明带及卵细胞膜注入到形态正常并成熟的卵母细胞胞浆内。拟行 ICSI 的男方必须排除遗传性疾病,必要时进行遗传咨询。
(2) 植入前遗传学诊断(preimplantation genetic diagnosis, PGD)指从体外受精的胚胎取部分细胞进行基因检测,排除致病基因的胚胎后才进行移植,可以防止遗传病的发生。
5. 辅助生殖治疗中男科医生工作注意事项 由于目前男性不育症多数病因未明,虽然 ART 能使得部分不孕不育夫妇获得自己的子代,但 ART 并非解决不孕不育的首选途径。ART 所引发的一系列伦理、道德、法律、社会、政治与经济方面的顾虑,在学术界与国际社会已引起了广泛讨论与争议。在 ART 时代, 男科医生应该更加关注导致男性不育的病因研究。深入研究精子生成的调控机制有助于找到导致男性不育的真正病因,以便探寻合适的治疗,而不是毫无指征地简单、单纯选择 ART。
6. 辅助生殖技术治疗策略的选择 在治疗策略选择时,应遵循“降级原则”,
即首先选择损伤小的技术(药物治疗、人工授精),其次选择较复杂、昂贵、损伤性的方法(IVF-ET 或 ICSI)。如可排除女方因素,治疗策略的选择应视男方精液质量而定。在此基础上,结合其他临床因素,特别是精液处理后回收的前向运动精子数量,确定最佳的治疗方案。
五、 无精子症诊断与治疗
(一)无精子症诊断与分型
1. 无精子症病因分析 对于 3 次或 3 次以上精液离心(WHO 推荐转速
3000r/min,离心 15 分钟)后镜检未发现精子,同时排除不射精和逆行射精等即可诊断为无精子症[68]。造成无精子症的原因主要为缺乏促性腺激素的刺激作用、生精功能障碍或生殖道梗阻。在进行病因分析时,除了第三节所述病史、体格检查、精液分析以及性激素检测外,应将生殖系统超声及染色体检测列为常规检测项目。
睾丸体积较小往往提示原发性或继发性睾丸功能衰竭,同时伴有 FSH 水平升高至正常值上限 2~3 倍时,提示生精功能严重衰竭,预后不佳[69]。
归纳无精子症的病因分类包括以下几点:
(1) 先天性因素
1) 无睾症;
2) 睾丸下降不良(隐睾症);
3) 基因异常(染色体核型异常包括 Klinefelter 综合征、男性 XX 综合征、Y 染色体微缺失、其他基因突变等);
4) 生殖细胞发育不良(唯支持细胞综合征等);
5) 内分泌异常(HH 症、Kallmann 综合征);
6) 输精管道发育异常。
(2) 获得性因素
1) 创伤;
2) 睾丸扭转;
3) 生殖道感染(附睾炎、睾丸炎、附睾结核、生殖道梗阻等);
4) 睾丸肿瘤;
5) 外源性因素(药物、毒素、长期服用棉籽油、放射线、热损伤等);
6) 慢性系统性疾病(肝硬化、肾衰竭等);
7) 精索静脉曲张;
8) 医源性损伤(输精管结扎术后,其他引起睾丸血供损伤或生殖管道梗阻的外科手术等)。
(3) 特发性
2. 诊断分型 无精子症病因复杂,对于诊断分型世界各地区尚未统一。
(1) 根据解剖结构的经典分型
1) 睾丸前性无精子症:主要为各种原因造成的促性腺激素低下所致的无精子症。其他外源性或内源性激素异常如雌激素、糖皮质激素过多,可导致曲细精管和管周的不可逆性硬化,造成继发性睾丸功能衰竭致使精子发生减弱、成熟障碍,甚至无法产生精子。
2) 睾丸性无精子症:主要为基因异常和生精功能障碍两类。
3) 睾丸后性无精子症:主要为生殖道梗阻,包括输精管道发育不全、感染或医源性损伤所致。
(2) 以精确诊断为目标的分型[70]:有学者从无精子症的精确诊断与治疗选择角度,将无精子症分为以下三类:
1) 梗阻性无精子症(obstructive azoospermia,OA):临床表现为睾丸有正常生精功能,由于双侧输精管道梗阻导致精液或射精后的尿液中未见精子或生精细胞。睾丸容积和血清 FSH 水平基本正常。生殖系统超声检查可发现梗阻征象。根据超声检查得出的梗阻部位可细分为睾丸内梗阻、附睾梗阻、输精管梗阻、射精管口梗阻等。重点要明确梗阻部位、程度、范围、梗阻时间及梗阻原因等,从而选择合适的治疗方式。对于 CBAVD 患者,大部分研究认为患者生精功能属正常,但也有一些研究认为 CBAVD 患者生精功能较一般 OA 患者减退[71]。
2) 非梗阻性无精子症(nonobstructive azoospermia,NOA):排除了上述梗阻因素的一类睾丸生精功能障碍性疾病,包括各种下丘脑垂体疾病所致的生精功能改变,以及不同病因所致的原发性生精功能衰竭,分型为 NOA。临床诊断时生殖系统超声检查没有发现明显梗阻征象,患者睾丸容积往往较小(<10ml),血清 FSH 水平根据不同情况可表现为减低、正常或升高(可高于正常上限 2 倍以上)[72]。这类患者的睾丸不能产生精子或只产生极少量精子,导致精液中无法找到精子。通常由先天或后天因素导致。
3) 混合型无精子症(combined azoospermia):对于一侧或双侧睾丸容积较小、质地软,血清 FSH 水平升高及存在其他生精功能障碍表现,同时又存在梗阻性因素的患者,无法根据一般检测区分 OA 或是 NOA。这部分患者可能同时存在睾丸生精功能障碍以及部分输精管道梗阻,分型为混合型无精子症。有时单侧输精管道梗阻的患者可表现为无精子症是由于输精管道未梗阻侧的睾丸生精功能障碍所致。
(二)无精子症治疗选择
对于无精子症的治疗应结合患者自身状况、意愿以及不同诊断分型,选择不同的治疗方案。
1. 经典分型 根据其解剖部位及相应的病因进行相应的治疗选择。
2. 精确诊断分型 根据其分型结果进行相应的治疗选择[70]:
(1)OA 的治疗选择:主要根据梗阻的原因、程度、部位、性质和范围选择输精管道再通手术、药物治疗或 ART 治疗。外科治疗详见前述。对于睾丸内梗阻等无法实施外科手术或术后疗效欠佳的患者可通过取精术获取精子后进行ART 治疗。在 ART 治疗之前,需进行遗传咨询及子代遗传风险评估。CBAVD 患者在接受 ART 治疗前,应对患者本人及其配偶进行 CFTR 基因检测。如果配偶为 CFTR 基因携带者,需要进一步接受遗传咨询以决定是否接受夫精 ICSI 治疗或 PGD 治疗[73],并需对其 ART 治疗子代严密随访。
(2) NOA 的治疗选择:一般情况较差的患者,如睾丸容积小于 6ml、FSH 水 平明显升高等,可直接选择 AID 或领养。其他患者可尝试对因治疗或经验性药物治疗,如治疗无效则可选择取精术或睾丸活检进行病理组织学检查以明确睾丸生精状况[74]。对因治疗主要针对合并严重精索静脉曲张患者,尤其是伴睾丸萎缩者,术后可能改善睾丸生精功能而产生精子[75]。HH 症治疗详见男性不育症治疗有关内容。药物治疗并无特效药,部分经验性药物治疗取得了一定疗效,但仍存在争议。
1) 克罗米芬:通过提高血清 FSH 和 LH 水平,促进睾丸产生睾酮。有研究报道使用克罗米芬治疗可促进特发性无精子症患者产生精子或提高睾丸取精成功率[76]。起始剂量为每天口服 50mg,治疗期间需严密监测血清睾酮水平。
2) 芳香化酶抑制剂:部分无精子症患者睾酮水平(ng/dl)与 E2 水平(pg/ml)比值偏低(<10)。芳香化酶抑制剂具有抑制雄激素转化为 E2 作用,从而增加睾酮水平,促进精子成熟和精子数量的增加。有报道使用芳香化酶抑制剂睾内酯每天 100~200mg 口服治疗,提高血清睾酮水平,有利于精子的发生[77]。其他临床可选择的药物有阿那曲唑、来曲唑等,但价格昂贵,临床应用较少。
对 Klinefelter 综合征,目前无明确治疗方法可改善患者生精功能。有研究报道对 Klinefelter 综合征患者进行睾丸切开显微取精术(micro-TESE),部分患者找到精子进行了 ICSI 治疗(应进行植入前诊断)[78]。但使用这些精子是否会将异常的核型传递给下一代仍存在争议。
对所有 NOA 患者,只要患者主观意愿强烈,在明确告知患者手术风险的前提下,可实施包括 micro-TESE 在内的各种取精术[79]。在进行睾丸取精术前,必须根据患者的检测结果情况进行生精预测,对预测结果较差者,需与患者及其家属共同商讨以决定是否进行诊断性取精术。有学者通过人工神经网络技术,结合前述各项生精预测指标及血清/精浆瘦素(leptin)水平对 NOA 患者进行取精成功率智能预测,取得一定效果[80]。同时,无论何种取精术,一旦找到精子都应超低温冷冻保存,用于后续 ICSI 治疗。
对染色体异常,如 Y 染色体微缺失,可直接选择 AID 或领养。部分 AZFc 缺失患者可尝试进行睾丸取精术,如获取精子则可进行 ART 治疗[81]。Y 染色体微缺失可以经 ICSI 技术遗传给男性子代,建议进行 PGD 治疗。
(3) 混合型无精子症的治疗选择:首选诊断性取精术或睾丸活检明确睾丸生精状况。若找到精子应同时冷冻保存为后续进行 ICSI 治疗做准备。一般不建议外科再通手术。
无精子症诊疗策略流程详见附录 3。
【参考文献】
[1] WHO. manual for the standardized investigation and diagnosis of the infertile couple. Cambridge University Press, 2000: 7.
[2] A. Jungwirth, T. Diemer, G. R. Dohle, etal. Guidelines on Male Infertility. European Association of Urology, 2013: 7.
[3] 吴阶平.吴阶平泌尿外科学.济南:山东科学技术出版社,2004.1491-1511.
[4] Auger J, Kunstmann JM, Czyglik F, et al. Decline in semen quality among fertile men in Paris during the past 20 years. N Engl J Med, 1995,332(5): 281-285.
[5] 张树成,王洪毅. 1981-1996 年我国有生育力男性精液质量的变化分析. 生殖与避孕,1999,19(1):27-33.
[6] 梁小薇,卢文红,陈振文,等. 过去 25 年中国有生育力男性精液参数变化的回顾性研究. 中华男科学杂志,2008,14(9):775-778.
[7] 坎贝尔-沃尔什泌尿外科学:第 9 版/(美)魏恩(Wein, A. J.),等原著;郭应禄,周利群主译. 北京:北京大学出版社,2009:638.
[8] Ma X, Dong Y, Matzuk MM, et al. Targeted disruption of luteinizing hormone beta-subunit leads to hypogonadism, defects in gonadal steroidogenesis, and infertility. Proc Natl Acad Sci U S A,2004, 101(49):17294-17299.
[9] Foresta C, Bettella A, Garolla A, et al. Treatment of male idiopathic infertility with recombinant human follicle-stimulating hormone: a prospective, controlled, randomized clinical study. Fertil Steril,2005, 84(3):654-661.
[10] Sikka SC, Wang R. Endocrine disruptors and estrogenic effects on male reproductive axis. Asian J Androl, 2008, 10(1): 134-145.
[11] Krassas GE, Pontikides N, Deligianni V, et al. A prospective controlled study of the impact of hyperthyroidism on reproductive function in males. J Clin Endocrinol Metab, 2002, 87(8): 3667-3671.
[12] Vorona E, Zitzmann M, Gromoll J, et al. Clinical, endocrinological, and epigenetic features of the 46,XX male syndrome, compared with 47,XXY Klinefelter patients. J Clin Endocrinol Metab., 2007, 92(9): 3458-3465.
[13] Hadziselimovic F, Hocht B, Herzog B, et al. Infertility in cryptorchidism is linked to the stage of germ cell development at orchidopexy. Horm Res, 2007, 68(1): 46-52.
[14] McLachlan RI. Basis, diagnosis and treatment of immunological infertility in men. J Reprod Immunol, 2002, 57(1-2): 35-45.
[15] Krause W, Bohring C. Male infertility and genital chlamydial infection: victim or perpetrator? Andrologia,2003, 35(4): 209-216.
[16] Oliva A, Spira A, Multigner L.Contribution of environmental factors to the risk of male infertility. Hum Reprod, 2001, 8: 1768-1776.
[17] Delbarge W, Batar I, Bafort M, et al. Reture to fertility in nulliparous and parouswomen after removal of the GyneFix intrauterine contraceptive system. Eur J Contracept Reprod Health Care, 2002, 7(1): 24-30.
[18] Shefi S, Turek PJ. Definition and current evaluation of subfertile men. Int Braz J Urol. 2006, 32(4): 385-397.
[19] Keel BA. Within and between-subject variation in semen parameters in infertile men and normal semen donors. Fertility and Sterility, 2006, 85: 128-134.
[20] 世界卫生组织人类精液检查与处理实验室手册/世界卫生组织著;谷翊群等
译. 北京:人民卫生出版社,2011: 192..
[21] 世界卫生组织人类精液检查与处理实验室手册/世界卫生组织著;谷翊群等译. 北京:人民卫生出版社,2011: 34-36.
[22] 世界卫生组织人类精液及精子-宫颈粘液相互作用实验室检验手册(第四版)
/世界卫生组织著;谷翊群等译. 北京:人民卫生出版社,2001: 51.
[23] Du J, Li FH, Guo YF, et al. Differential diagnosis of azoospermia and etiologic classification of obstructive azoospermia: role of scrotal and transrectal. US Radiology,2010, 256(2): 493-503.
[24] Adeghe JH. Male subfertility due to sperm antibodies. Obstet Gynecol Surv,
1992, 48(1): 1-8.
[25] Gdoura R, Kchaou W, Ammar-Keskes L, et al. Assessment of Chlamydia trachomatis, Ureaplasma







 cjzy@chengjipharm.com
cjzy@chengjipharm.com 北京市顺义区中北工业区(北石槽镇)
北京市顺义区中北工业区(北石槽镇)